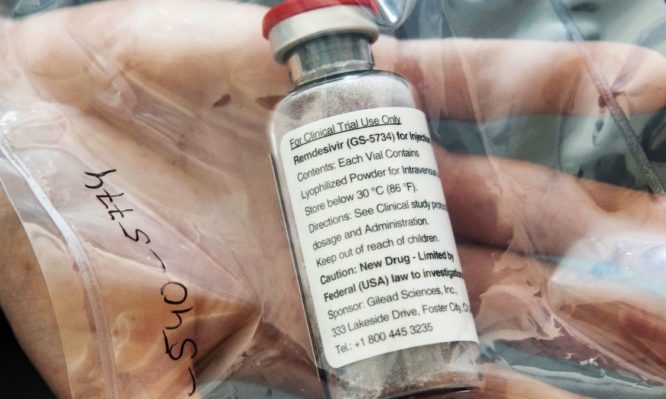
Η Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) δεν έχει ακόμη εγκρίνει φάρμακα για τη θεραπεία του κορωνoϊού. Ωστόσο, προχωρά σε άδεια κυκλοφορίας “έκτακτης ανάγκης” για το Remdesivir, σύμφωνα με δημοσίευμα των “New York Times”. Η άδεια θα δοθεί με διαδικασία fast track, σύμφωνα με υψηλόβαθμο κυβερνητικό αξιωματούχο.
Ο αμερικανός επιδημιολογός, Anthony Fauci, δήλωσε σε δημοσιογράφους στον Λευκό Οίκο ότι τα πρώιμα αποτελέσματα σχετικά με την αποτελεσματικότητα της ρεμντεσιβίρης δείχνουν ελπιδοφόρα, όμως χρειάζεται περισσότερη μελέτη. Πρόσθεσε, επίσης, ότι δεν γνωρίζει το χρονοδιάγραμμα έγκρισης του φαρμάκου από το FDA.
Εκπρόσωπος του FDA ανέφερε στο CNN, ότι o Οργανισμός βρίσκεται σε συνομιλίες με την εταιρεία Gilead Sciences που παράγει το φάρμακο, για τη δυνατότητα διάθεσης της ρεμντεσιβίρης σε ασθενείς. “Ως μέρος της δέσμευσης του FDA να επισπεύσει την ανάπτυξη και τη διαθεσιμότητα πιθανών θεραπειών για τον COVID-19, ο Οργανισμός έχει εμπλακεί σε συζητήσεις με την Gilead Sciences σχετικά με τη διάθεση του Remdesivir στους ασθενείς το συντομότερο δυνατό και ανάλογα με την περίπτωση”, δήλωσε ο εκπρόσωπος του FDA, Michael Felberbaum.
Τι έδειξε η μελέτη του Remdesivir
Στη δοκιμή συμμετείχαν 1.063 ασθενείς σε 47 περιοχές των ΗΠΑ και σε άλλες 21 χώρες στην Ευρώπη και την Ασία. Μέχρι σήμερα, αυτή είναι η μεγαλύτερη μελέτη για τη ρεμντεσιβίρη, με διαθέσιμα αποτελέσματα.
Η μελέτη, η οποία χρηματοδοτήθηκε από την κυβέρνηση των ΗΠΑ, ανέφερε ότι οι ασθενείς που έλαβαν remdesivir ανέκαμψαν γρηγορότερα από τους ασθενείς που δεν έλαβαν το φάρμακο.
Ο επικεφαλής του Εθνικού Ινστιτούτου Αλλεργίας και Λοιμωδών Νοσημάτων δήλωσε αισιόδοξος για τα αποτελέσματα. “Τα στοιχεία δείχνουν ότι το Remdesivir έχει σαφή, σημαντική, θετική επίδραση στη μείωση του χρόνου της ανάκαμψης των ασθενών”, είπε ο Anthony Fauci στο Λευκό Οίκο κατά τη διάρκεια συνάντησης με τον Πρόεδρο Trump.
Τα προκαταρκτικά αποτελέσματα μιας μεγάλης κλινικής μελέτης δείχνουν ότι το remdesivir μείωσε τον χρόνο ανάρρωσης στους ασθενείς με κορωνοϊό, από 15 έως 11 ημέρες. Η επίδραση του φαρμάκου στη νόσο COVID-19 έχει παρόμοια αποτελέσματα με αυτή του αντιιικού φαρμάκου κατά της γρίπης Tamiflu. Το Tamiflu επίσης δεν θεραπεύει τους ασθενείς γρήγορα, αλλά μπορεί να περιορίσει τη διάρκεια της νόσου.
“Παρόλο που η βελτίωση κατά 31%, δεν μοιάζει να είναι νόκ-άουτ της τάξεως του 100%, είναι πολύ σημαντική απόδειξη για την αποτελεσματικότητα του φαρμάκου”, δήλωσε ο Fauci για το Remdesivir. “Αυτό που έχει αποδειχθεί είναι ότι πρόκειται για ένα φάρμακο, που μπορεί να περιορίσει σημαντικά τον ιό”.
Σύμφωνα με τον Fauci, η ρεμντεσιβίρη μπορεί πλέον να γίνει η πρώτης γραμμής θεραπεία για τις σοβαρές περιπτώσεις της Covid-19. Το φάρμακο χορηγείται ενδοφλεβίως για 10 ημέρες.
Το Remdesivir μπορεί επίσης να μειώσει την πιθανότητα θανάτου στους ασθενείς
Τα αποτελέσματα κατέληξαν, επίσης, και στο συμπέρασμα ότι υπάρχει όφελος επιβίωσης στους ασθενείς που λαμβάνουν το φάρμακο. Το ποσοστό θνητότητας στην ομάδα που έλαβε το remdesivir ήταν 8% έναντι του 11,6% που εμφάνισε η ομάδα που έλαβε το εικονικό φάρμακο (placebo).
Υπό φυσιολογικές συνθήκες – εκτός πανδημίας – παρόμοια δεδομένα σχετικά με την αποτελεσματικότητα ενός φαρμάκου δεν θα ανακοινώνονταν γρήγορα στους ασθενείς. Όμως με δεδομένα τα πρώτα θετικά στοιχεία της μελέτης του Remdesivir, οι ερευνητές ενημέρωσαν εγκαίρως την ομάδα του εικονικού φαρμάκου, εάν θέλει να λάβει, επίσης, τη θεραπεία: “Εάν υπάρχει σαφής ένδειξη για την αποτελεσματικότητα ενός φαρμάκου, έχεις την ηθική υποχρέωση να ενημερώσεις αμέσως τους ασθενείς στην ομάδα του εικονικού φαρμάκου, ώστε εάν θέλουν να μπορούν να έχουν πρόσβαση”, δήλωσε ο Fauci.
Το Remdesivir συγκαταλέγεται μεταξύ πολλών φαρμάκων που δοκιμάστηκαν κατά της νόσου COVID-19, αλλά η μελέτη NIAID είναι η πρώτη που διεξήχθη με βάση τις προϋποθέσεις που θέτει το FDA για να δώσει έγκριση στο φάρμακο.
Ωστόσο, ο Παγκόσμιος Οργανισμός Υγείας (ΠΟΥ) δήλωσε ότι είναι πολύ νωρίς για να σχολιάσει τα αποτελέσματα της δοκιμής Remdesivir που κυκλοφόρησαν την Τετάρτη. Οι υπεύθυνοι του ΠΟΥ ανακοίνωσαν ότι χρειάζονται επιπλέον στοιχεία από διάφορες μελέρες πριν τοποθετηθεί ο Οργανισμός.
“Μπορεί κάποιες φορές να απαιτηθούν πολλές δημοσιεύσεις μελετών για να προσδιοριστεί ο τελικός αντίκτυπος ενός φαρμάκου”, δήλωσε ο Δρ Mike Ryan, εκτελεστικός διευθυντής του προγράμματος έκτακτης ανάγκης Υγείας του ΠΟΥ.